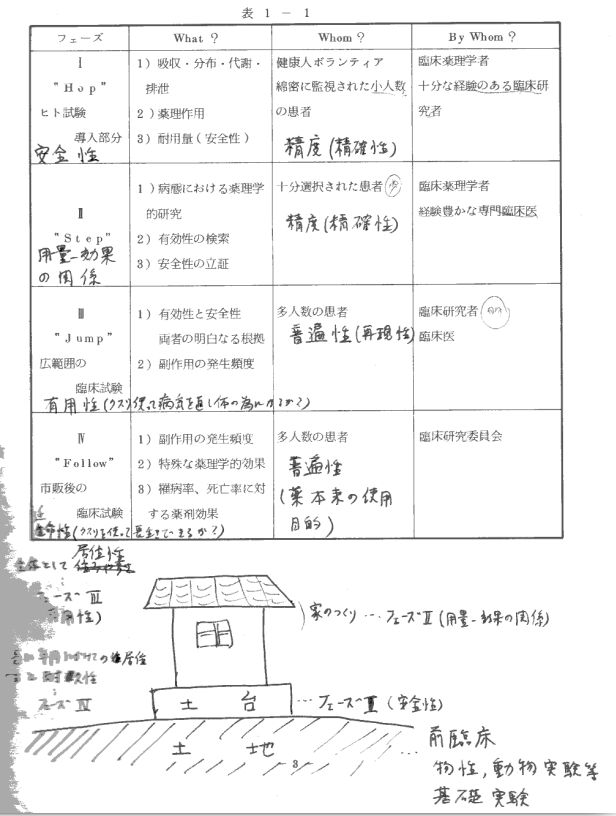
※この表は、昔々、製薬業界でメシを食っていた時に、新入社員研修用に作ったテキストの一部です。
医薬品開発のための臨床試験のことを、特に治験といいます。
原論文「Safety and Efficacy of th BNT162b2 mRNA Covid-19 Vaccine(New Engl J Med. Dec 10, 2020)」は、ファイザー(Pfizer)とバイオンテック(BioNTech)が開発した、COVID-19用mRNAワクチンBNT162b2の有効性と安全性を評価した国際共同第1/2/3相試験の中の、第2/3相試験部分の結果を報告したものです。 第1/2/3相試験という言葉は、製薬業界の住人や医学研究者でも耳慣れないものだと思います。
ワクチンなどの医薬品開発は、下表のように第1相(ホップ)・第2相(ステップ)・第3相(ジャンプ)・第4相(フォロー)という4段階で行うのが普通です。 第1相(ホップ)は安全性の検討、第2相(ステップ)は用量−効果関係の検討、第3相(ジャンプ)は有用性(有効性+安全性)の検討、そして第4相(フォロー)は延命性の検討を行います。 その際、それぞれの相は順番に行い、効果が期待できなかったり、安全性に問題があったりした時は途中ですぐに開発を中止します。 そのため医薬品の開発は、ヒトを対象にした臨床試験段階に入ってからでも普通は5〜10年かかります。

ところがパンデミックという緊急事態中であることから、開発期間を短縮するためにBNT162b2の開発は「ホップ・ステップ・ジャンプ」の段階を同時並行的に進めることにし、それを「第1/2/3相試験」と呼ぶことにしたのです。 そしてこの臨床試験を途中で終了し、実質的な第3相試験と市販後の第4相試験を、ワクチンを接種した人達のリアルワールドデータ(臨床試験や臨床研究ではなく、実際の臨床現場から得られた患者やワクチン接種者のデータ)によって行うことにし、わずか1年足らずでアメリカ食品医薬品局FDA(Food and Drug Administration)から緊急使用認可EUA(Emergency Use Authorization)を受けました。
この特別措置の是非については補足2で詳しく説明することにして、とりあえず論文をチェックしてみましょう。