ここで、あらためてBNT162b2の臨床試験結果をまとめておきましょう。 BNT162b2の開発は、医薬品開発における第1相試験と第2相試験と第3相試験を同時並行的に実施しました。 そして原論文「Safety and Efficacy of th BNT162b2 mRNA Covid-19 Vaccine(New Engl J Med. Dec 10, 2020)」は、そのうちの第2/3相試験の部分を報告したものです。
1番と2番に関して、本来の医薬品開発手順では第1相試験と第2相試験と第3相試験は順次実施し、前の相の試験から得られた結果に基づいて次の相の試験の作業仮設を組み立て、それを検証することによって医薬品候補の有効性と安全性を安全かつ確実に検証します。
ところがこの臨床試験の作業仮設と、それに基づいた試験の必要例数は、第2相試験の結果に基づいて設定したのではなく、緊急使用許可を得るのに必要な最低条件に基づいて設定しています。 その結果、COVID-19が170例ほどしか発症せず、実質的に第2相試験に相当する例数になっています。 そこで本来は承認前に行う必要がある第3相試験を、緊急使用許可を得た後のリアルワールドデータの分析で代用することにしたのだと思います。
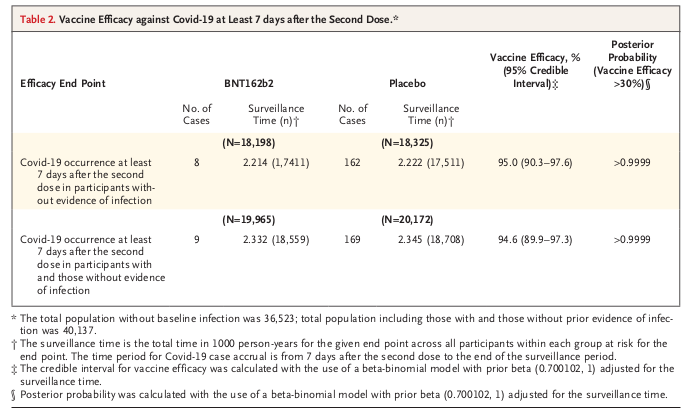
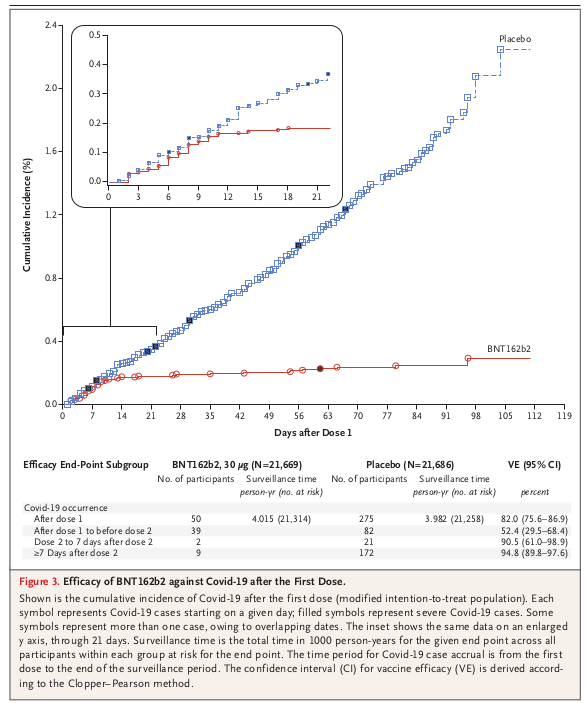
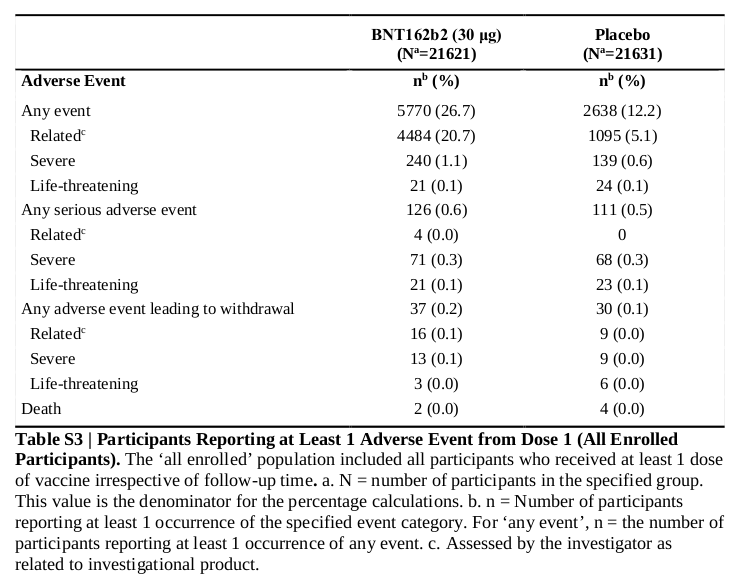
3番と4番は後回しにして、5〜9番からBNT162b2はCOVID-19の発症を非常に高い確率で予防すると考えられます。 ただしBNT162b2を接種してCOVID-19を発症しなくても、SARSコロナウイルス2のキャリアー(COVID-19を発症しないものの、SARSコロナウイルス2を他人に感染させる可能性のある人)である可能性を否定できません。 またBNT162b2を接種してCOVID-19を発症した時、重症化する危険性と死亡する危険性はBNT162b2非接種者と変わらない可能性を否定できません。


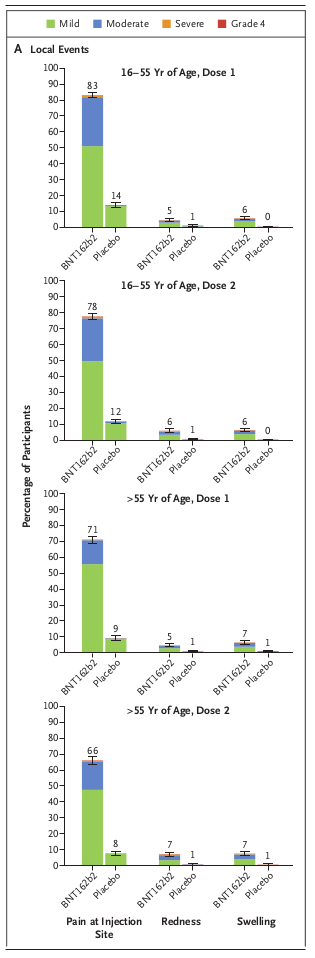
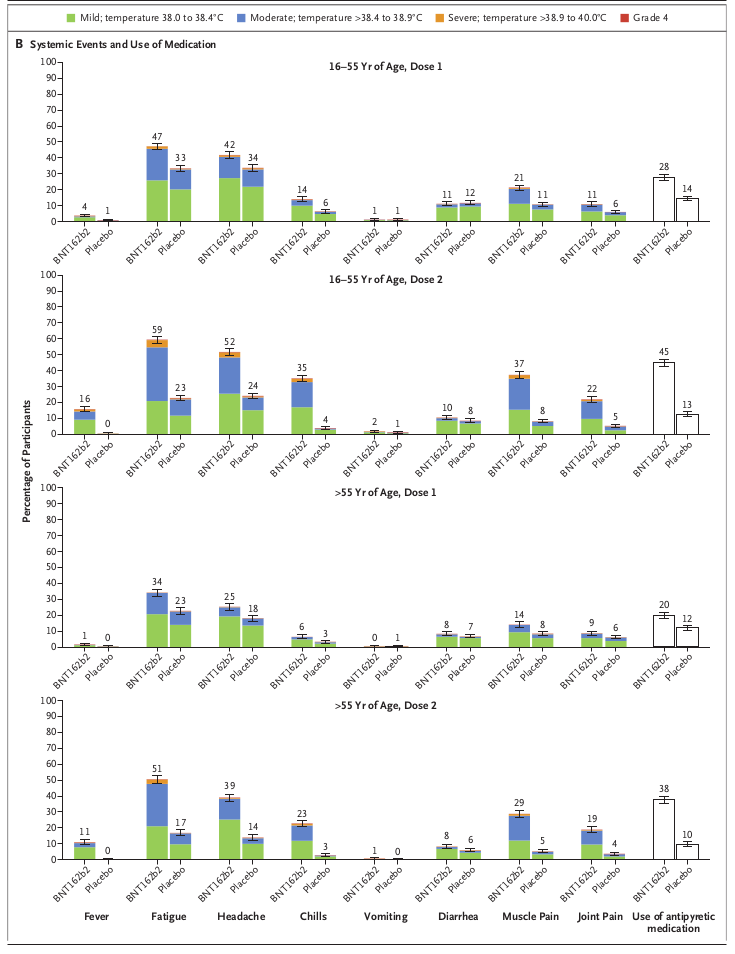
10番から、BNT162b2の副作用(副反応)として反応原性に起因する一過性の局所反応と全身反応、例えば接種部疼痛、倦怠感、頭痛等が考えられます。 ただし接種3ヵ月以後に有害事象が発現するかどうかと、発現率が非常に小さい(0.001%未満)有害事象が発現するかどうかは不明です。 接種後3ヵ月以後に発現する可能性のある有害事象としては抗体依存性免疫増強(ADE)やワクチン関連疾患増強現象(VMED)などがあり、発現率が非常に小さい有害事象としてはアナフィラキシーがあります。
2021年1月末時点でわかっているところでは、BNT162b2の緊急使用許可後、2020年12月14日~2021年1月18日の間に初回接種を受けた9,943,247例中、アナフィラキシーが50例報告されました。 その発現率は約0.0005%(0.5件/10万接種)であり、それによって死亡する確率は約0.0000001%(1件/10億接種)です。
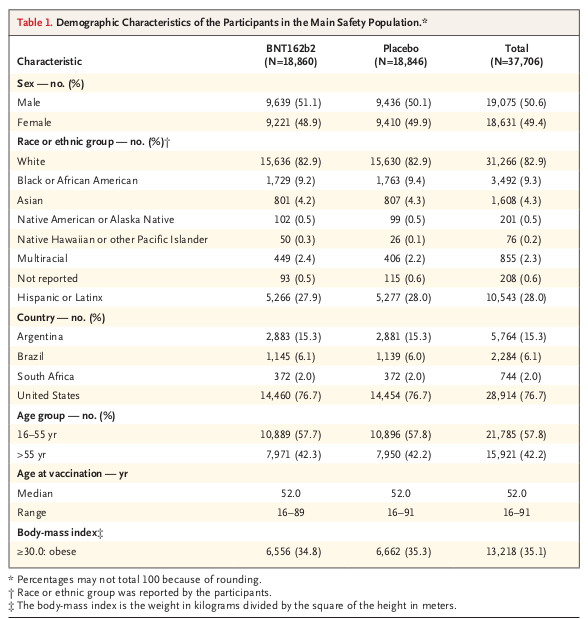
3番と4番に戻り、臨床試験の被験者はアメリカ国籍が77%で、白人が83%です。 そのためこの結果は主としてアメリカ国籍の白人成人に一般化できます。 でもその他の国籍や人種や子供――例えば日本国籍の黄色人種――に一般化できるかどうかは不明です。
一般に、医薬品の有効性と安全性は体質(遺伝子)と生活環境によって異なります。 そのため外国で開発された医薬品を日本で使用する時は、普通の医薬品候補と同じ開発手順に従い、日本国内で臨床試験を実施して有効性と安全性を検証することが厚労省の承認規準になっています。
ワクチン有効率は接種対象集団の感染率や抗体保有率で変わります。 そのため外国で開発されたものが、生活環境が異なる日本でも同じように有効かつ安全とは限りません。 しかも今回のBNT162b2は病態がまだ正確に判明していないCOVID-19用のワクチンであると同時に、世界初のmRNAワクチン(メッセンジャーRNAを用いたワクチン)です。
インフルエンザワクチンのように数多くの前例があれば、外国で開発されたワクチンが日本でも同じように有効かつ安全かどうか、ある程度は予想できます。 しかし感染症もワクチンの原理も前例が無いのですから、外国で開発されたものが日本でも同じように有効かつ安全かどうか全く予想できません。
事実、この臨床試験のプロトコール(試験実施計画書)を読むと、ファイザーは(FDAも?)BNT162b2のワクチン有効率を60〜80%程度と予想していたようです。 ところが実際に臨床試験を実施したところ、ワクチン有効率が95%という予想外に高い結果になりました。 このことからも感染症もワクチンの原理も世界初のものについては臨床試験結果の予想が難しいことがわかります。
まして感染率も死亡率もアメリカの40分の1程度である日本で、その感染率と死亡率の低さの原因がまだ正確には判明していないにもかかわらず、アメリカと同じようにBNT162b2が有効かつ安全と考えるのは無謀です。 そのためBNT162b2についても、本来なら従来の医薬品開発手順に従い、日本国内で臨床試験を実施して有効性と安全性をしっかり検証してから厚労省が承認すべきだと思います。
とは言うものの、医療現場でCOVID-19の患者が眼の前で死亡する経験をされている医療従事者の人達が、一刻も早いワクチン承認を希望されているのはものすごくわかる気がします。 幸い、ワクチン有効率は接種対象集団の感染率や抗体保有率で変わりますが、安全性はあまり変わらない可能性が高いと思います。
そして特に問題になりそうなアナフィラキシーの原因は、BNT162b2に添加されているポリエチレングリコール(PEG)の可能性が高いと考えられています。 もしそうであれば、ポリエチレングリコールのアナフィラキシーの頻度と致死率は日本でも外国でもあまり変わらないと言われているので、日本でもそれほど問題にはならないと思います。
そこでとりあえず安全性を検証するための必要最小限の臨床試験を行い、それで問題が無ければ、日本でも緊急使用許可(日本の場合は特例承認)することが考えられます。 そしてワクチン接種を開始したら、そこから得られるリアルワールドデータを用いて有効性と安全性を検討すると同時に、それと平行して厚労省の班会議等が主導して全国レベルの大規模かつ厳密な臨床試験を行い、ワクチンの有効性と安全性をしっかりと検証するという次善の策が考えられます。 もしそのような臨床試験が実施されるようなら、データ解析屋としてでも被験者としてでもいいので、僕も参加したいと思います。
ほとんどの医薬品は生体にとって「異物」であり、その異物の薬理作用によって強引に疾患を治療します。 言わば「毒をもって毒を制す」ようなものです。 そのため、どうしても安全性に問題があるものが多くなります。
それに対してワクチンは、やはり生体にとって「異物」を投与しますが、生体が本来持っている「異物」に対する免疫反応を利用して異物に対する免疫をつけます。 言わば災害が起きたと想定して防災訓練を行い、それによって防災体制をしっかりと構築させるようなものです。 しかもワクチンは健康な人に接種するので、身体の色々な機能が弱っている病人と違って有害な副作用が発現しにくいという特徴があります。 そのため普通の薬剤と比較すると有効性も安全性も非常に高くなります。
このようにワクチンは有効性も安全性も非常に高い上に、一生に1度とか、1年に1度接種するだけで疾患を90%以上も予防します。 こんな優秀な医薬品は他になく、まさに人類の歴史上、画期的な医薬品と言って良いと思います。 あまりにも優秀すぎて疾患を減らしてしまうので沢山売れず、はっきり言って製薬会社にとってはあまり儲からない製品です。 製薬会社にとって儲かる製品とは、疾患を根治せずに症状だけ改善するため、1日に毎食後3回服用し、それを毎日毎日、ほとんど死ぬまで何十年間も続けなければならない慢性疾患用薬剤、例えば高脂質血症薬のような薬剤です。
それに対してワクチンは開発にやたらと時間と金がかかる上に、1回の接種で疾患予防効果が非常に高いので儲けが少なく、製薬会社(の経営陣)としては実はあまり積極的に開発したくない薬剤です。 そして製薬会社にとって儲けが少ない医薬品とは、とりもなおさず消費者にとってメリットが多い医薬品なのです。
ちなみに、日本感染症学会ワクチン委員会の「COVID-19ワクチンに関する提言」も参考になるので読んでみてください。