次に安全性の解析結果を見てみましょう。 ワクチンの安全性で問題になるのは、主に副作用(副反応)による健康被害です(副反応はワクチンの副作用についてだけ使う日本独特の用語です)。 ワクチンの副作用には接種した直後〜数日以内に発現するものと、2〜4週間後に発現するものと、接種者がウイルスに感染した時に発現するものがあります。
1つ目のものとしてはアレルギー反応や接種部の疼痛・発赤・腫脹などがあります。 特に重篤なアレルギー反応であるアナフィラキシーは何かと問題になりがちです。 2つ目のものとしては脳神経障害や末梢神経障害などがあります。 3つ目のものとしては抗体依存性免疫増強ADE(Antibody-Dependent Enhancement)やワクチン関連疾患増強現象VMED(vaccine-mediated enhanced disease)など、ワクチンによって抗体ができ、その抗体のために感染症や他の疾患が悪化する副作用があります。 この副作用はワクチンによって抗体ができた後なら、いつでも起こり得ます。
この臨床試験ではワクチンの安全性を2通りの方法で検討しています。 ひとつは被験者のサブグループ(8,183例)を対象にして、反応原性(reactogenicity)――ワクチンが抗体と反応する性質――に起因する局所反応(local reactions)と全身反応(systemic reactions)を観察したものです。 これは主として1つ目と2つ目の急性期(だいたい4週間未満)の副作用を検討するためのものです。
もうひとつは被験者全体(43,252例)を対象にして、全ての有害事象(adverse event)を検討したものです。 これは主として亜急性期(だいたい3ヶ月未満)の副作用を検討するためのものです。 そして慢性期(だいたい3ヵ月以上)の副作用については、試験終了後、被験者を2年間フォローして検討することになっています。 またワクチンの緊急使用許可されてから大規模なワクチン接種を行い、そこから得られるリアルワールドデータを用いて検討することにもなっています。
一般に医薬品の「使用上の注意」に副作用を記載する時、発現頻度に応じて次のような副詞を使うことになっています。
このことを踏まえて、医薬品開発の第4相に相当する市販後調査PMS(Post Marketing Surveillance)では1万例以上の使用例の副作用調査を行い、その結果を厚労省に提出します。 「1万例以上」というのは、0.1%(1000例に1例発現)の発現頻度の副作用を確定するには、少なくとも10例以上の副作用発現例を検討する必要があるからです。
この臨床試験のBNT162b2接種群は約2万例です。 そのため急性期〜亜急性期の副作用については、すでに市販後調査に相当する検討が終わっていることになります。 したがってBNT162b2の急性期〜亜急性期の安全性は十分に検討されていると思います。 それに対して有効性は実質的に170例のCOVID-19発症者によって検討しているだけです。 そのため有効性と比較すると安全性の検討結果ははるかに信頼性が高いのです。
ただし通常の医薬品開発では、慢性期の副作用を検討するために1〜2年間の長期試験を実施します。 これはワクチンも例外ではなく、ワクチン開発に5年以上の時間がかかるのはこのことも理由の1つです。
ところがBNT162b2については、慢性期の副作用の検討を緊急使用許可されてから行うことにして開発期間を強引に短縮しています。 アメリカはCOVID-19による死亡率が約0.1%/1年(実数は約30万人)もあるので、この特別措置は致し方ないことかもしれません。 でも多くの医薬品開発に関わったデータ解析屋としては、BNT162b2が非常に優れた医薬品候補であり、できるだけ慎重かつ大切に育てて広く普及して欲しいと思っているだけに、この特別措置は少々残念です。
一般に、臨床試験では副作用と思われるものを有害事象(adverse event)として記録します。 有害事象とは臨床試験で発現した全ての好ましくない、または意図しない疾病や健康被害のことです。 例えば臨床試験中に交通事故で怪我をした時、それも有害事象に入れます。 有害事象の中でワクチンと因果関係があると推測されるものを副作用(side effect)と考え、副作用の中で有害なものを薬物有害反応(adverse drug reaction)――日本では慣習的に副作用とも言う――といいます。
臨床試験で全ての有害事象を記録するのは、ワクチンと因果関係が不明のものでも、プラセボ接種群よりも高い割合で発現していれば、とりあえず副作用候補と考えて今後の研究課題にするためです。
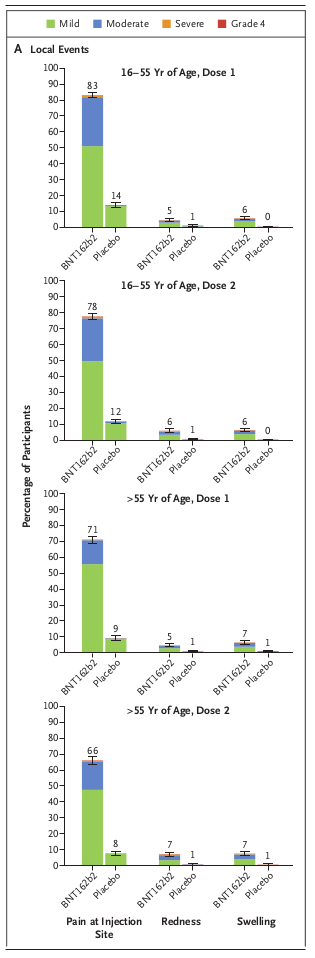
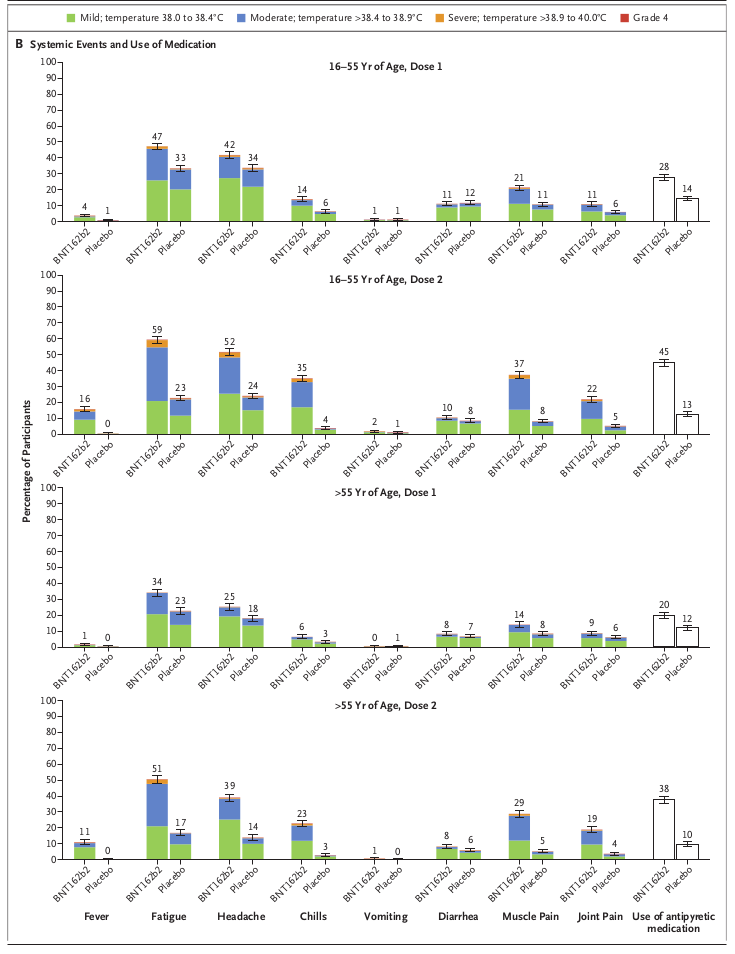
論文では8,183例の被験者サブグループを対象にした、反応原性に起因する局所反応がFigre 2のAに、全身反応がBにグラフ化されています。 通常、このようなグラフは発現例数を柱状グラフで表し、その割合を柱状グラフの中か横に記載します。 しかしこの論文では割合(%)そのものを柱状グラフで表し、その柱の頂上に割合の95%信頼区間をエラーバーで描いていて、具体的な例数は記載していません。 そのためBNT162b2接種群とプラセボ接種群の出現率の差の推定と検定ができません。 僕がまだ製薬企業にいたとして、もし部下がこんなグラフを描いたら怒鳴りつけるところです。


有害事象の場合、一応、発現率の差の推定と検定を行います。 しかしたいていは例数が少ないので、推定と検定結果の信頼性が低くなります。 そこで予防原則に従って、推定結果と検定結果の信頼性が低くても、プラセボ接種群よりも発現率が高ければ一応は副作用と考え、今後の研究課題にします。
Figure 2のAでは、やはり接種部疼痛(Pain at Injection Site)の発現率が高く、BNT162b2接種群で66〜83%、プラセボ接種群でも8〜14%あります。 これは反応原性に起因する反応ですから、当然の結果です。 これらの頻度が少ないワクチンは有効性も低い傾向があります。
Figure 2のBでは倦怠感(Fatigue)が34〜59%で、次が頭痛(Headache)の25〜52%です。 これらの有害事象は反応原性に起因すると考えられるので、とりあえず全て副作用と考えます。 でもどれも重篤なものではなく、しかも一過性なので、BNT162b2の安全性にとって大きな問題になるものは無いと考えて良いと思います。
被験者全体(43,252例)を対象にした、全ての有害事象の集計結果はAppendixのTable S3に記載されています。 こちらには発現例数と発現率がきちんと記載されています。 でも発現率の差の推定と検定が行われていないので計算してみました。 その結果、最初の3項目の発現率の差が有意水準5%で有意になりました。
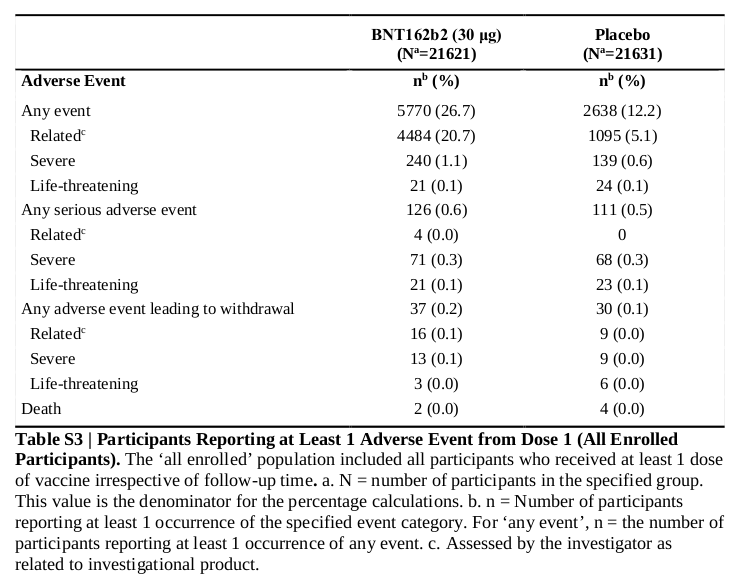
BNT162b2接種群とプラセボ接種群の、ワクチン有効率の差の95%信頼区間の幅は10%程度でした。 それに対して有害事象の発現率の差の95%信頼区間の幅は0.3〜2%です。 このことから、ワクチン有効率の解析結果と比べると有害事象の解析結果は信頼性が非常に高いことがわかると思います。
Table S3の有害事象全体と、その中で試験薬と因果関係ありと推測した有害事象は、主として反応原性に起因する局所反応と全身反応です。 そのためBNT162b2接種群の方が出現率が高いのは当然です。
3番目の有害事象全体の中の重症な有害事象は、主にFigure2のAとBのグラフ中で「Severe」と表示された橙色のものです。 FigureのAとBの橙色の部分を見ると確かにBNT162b2接種群の方がわずかに出現率が高く、全体ではプラセボ接種群との出現率の差が0.5%程度あるというのは納得できます。 ただし出現率の差がわずか0.5%であり、しかも致命的な有害事象(Life-threatening)とか重篤な有害事象(Any serious adverse event)ではないので医学的に大きな問題になるようなものではありません。
この3項目以後の有害事象の出現率の差については、有意水準5%で有意ではないだけでなく医学的に問題になるほどの差ではありません。 そのため急性期〜亜急性期(だいたい3ヶ月未満)についてはBNT162b2に重篤な副作用は無く、安全性に大きな問題は無いと考えて良いと思います。
なおTable S3の最後の行を見ると、死亡(Death)がBNT162b2接種群に2例、プラセボ接種群に4例あります。 論文の「ADVERSE EVENTS」中にそれらの死亡例の内訳が記載されています。 それによるとBNT162b2接種群の死亡例は動脈硬化症(arteriosclerosis)が1例、心停止(cardiac arrest)が1例です。 そしてプラセボ接種群の死亡例は脳出血(hemorrhagic stroke)が1例、心筋梗塞(myocardial infarction)が1例、死因不明(unknown causes)が2例です。
昨年(2020年)のアメリカの死亡率は約0.9%/年です。 そのため43,252例の被験者を平均46日間観測すれば49例ほど死亡するはずです。 したがってこの臨床試験中の被験者の死亡率はアメリカの平均死亡率の12分の1程度ということになります。 臨床試験ではリスクの多い人つまり重篤な疾患にかかっている人は除外し、しかも試験中は被験者が注意深く生活するので死亡率がこれくらい低くなっても不思議ではありません。
ここでワクチンの副作用、特にアナフィラキシーに関してマスコミなどがやたらと騒いでいるので、それについて少し説明しておきましょう。 この臨床試験では、BNT162b2接種群にもプラセボ接種群にもアナフィラキシーは1例も出現しませんでした。 しかしBNT162b2が緊急使用許可された後、2020年12月14日~2021年1月18日の間にこのワクチンの初回接種を受けた9,943,247例中、アナフィラキシーが50例報告されました。 その発現率は約0.0005%(0.5件/10万接種)で、95%信頼区間は0.0003〜0.0007%です。
この臨床試験のBNT162b2接種群は約2万例であり、発現率0.01%の副作用なら1例以上発現する確率が約88%あります。 でも発現率0.0005%の副作用は1例以上発現する確率が約10%しかありません。 そのためこの臨床試験でアナフィラキシーが1例も発現しなかったのは無理もありません。
アナフィラキシーを起こす物質は食物が最も多く、次が蜂などの昆虫、その次が薬剤です。 そして薬剤の中でアナフィラキシーを起こす確率が高いのは抗生剤、造影剤、解熱鎮痛剤、抗癌剤などです。 例えば代表的な解熱鎮痛剤であるアスピリンのアナフィラキシー発現率は約0.02%(20件/10万錠)です。 (アナフィラキシーについては「アナフィラキシー ガイドライン(日本アレルギー学会Anaphylaxis対策特別委員会編集)」参照)
ワクチンは健康な人に接種するので普通の薬剤よりもアナフィラキシー発現率が低く、例えばインフルエンザワクチンは約0.0001%(0.1件/10万接種)です。 BNT162b2のアナフィラキシー発現率0.0005%(0.5件/10万接種)はそれよりも高い値ですが、アスピリンの40分の1程度です。
そしてアナフィラキシーを起こした人が死亡する確率、つまりアナフィラキシーの致死率は約0.02%(2例/1万アナフィラキシー発症例)です。 したがってBNT162b2のアナフィラキシーで死亡する確率は0.0000001%(1件/10億接種)であり、極めて稀です。 そのため2020年12月14日~2021年1月18日の間にアナフィラキシーを起こした50例は全て回復し、死亡した人はいません。
アメリカはアレルギー体質の人が多いのか、アナフィラキシーの全発現率が1.6%/年もあります(日本のアナフィラキシーの全発現率は0.5%/年)。 その中でBNT162b2のアナフィラキシー発現率は約0.0005%(0.5件/10万接種)であり、それによって死亡する確率が0.0000001%(1件/10億接種)というのは、ものすごく低い値だというのがわかると思います。
それに対して、昨年のアメリカのCOVID-19による死亡率は0.1%(100人/10万人)です。 この臨床試験にはCOVID-19による死亡例も、BNT162b2の副作用による死亡例もありません。 そのため死亡率に対するBNT162b2の影響は今のところ不明であり、これから得られるはずの接種者のリアルワールドデータによって検討することになります。 でもBNT162b2のワクチン有効率が少なくとも90%以上あるので、COVID-19発症率を低くすることによって結果的に重症者と死亡者を減らす可能性が高いと思います。
そこでBNT162b2がCOVID-19による死亡率を10分の1程度に減らすと仮定すると、アメリカ国民3億3100万人全員が接種するとCOVID-19による死亡率は0.01%(10人/10万人)になり、実数にして27万人が助かります。 それに対してBNT162b2のアナフィラキシーで死亡する確率は0.0000001%(1件/10億接種)ですから、アメリカで死亡する人は多くてもたった1人です。 このことを考えると、アメリカが医薬品開発手順を強引に端折ってまでワクチンを短期間で開発し、大規模なワクチン接種を実施している理由がわかると思います。
反ワクチン派の人達が、よく「新型コロナで死ぬか、ワクチンで死ぬか?」などという極論を主張することがあります。 アメリカの場合、これは実際には、
「新型コロナで30万人が死ぬか、それともワクチンで27万人が助かり、副作用で1人が死ぬか?」
もちろんアメリカは(建前上は)自由の国ですから、「ワクチンは危ない!」と盲信し、ワクチンを接種しないのは個人の自由だと思います。 でもアメリカの医療現場でワクチン接種を実施している医療従事者の人達は、予防原則に従って、ワクチンの副作用に対する対応策を施しながらワクチンを接種しています。
そのためアメリカでワクチン反対運動をしたり、マスコミが反ワクチンを煽り立てたりするなら、この臨床試験と同程度以上の臨床試験を実施してワクチンの有効性と安全性を検討し、ワクチンによる死亡者の減少よりも副作用による死亡者の方が多いことを客観的なデータによって実証する必要があります。
そしてワクチン反対運動をした人とマスコミは、やはり予防原則に従って、ワクチンを接種しないことによって死亡するかもしれない27万人の人達の命を救うために医療現場で働くのがフェアであり、その責任があると思います。